شیمی تنها علمی است که علاوه بر اینکه همه 115 عنصر طبیعت را همراه نام خود دارد، با تسلط بر جهان بر تمام کائنات حکمرانی میکند، چون اگر لحظهای فعالیتهای این حکمران جبری طبیعت از کائنات حذف شود، حیات دیگر مفهومی نخواهد داشت، بلافاصله همه چیز متوقف خواهد شد؛ دیگر نوری از خورشید ساطع نخواهد شد، سوخت و سازی در بدن جانوران و گیاهان انجام نخواهد شد، هیچ تولیدی و فعالیت اقتصادی رخ نخواهد داد و... اهمیت و فرآیندهای این علم و فعالیتهای عمده آن درصنایع مختلف باعث شد گفتوگویی با دکتر نادر شکوفی عضو هیات علمی پژوهشگاه شیمی و مهندسی شیمی ایران داشته باشیم تا بیشتر پیرامون این علم و جذابیتهای آن به بحث بپردازیم.
شیمی چه کاربردهایی می تواند در زندگی روزمره هر فردی داشته باشد؟
شیمی در همه زمینه ها می تواند کاربرد داشته باشد. از همه وسایل دور و اطرافمان مانند مواد غذایی، شیمیایی، پوشیدنی، دارویی و ترکیبات آن مانند عطرها و رنگ ها یا تجهیزات عمومی که استفاده می کنیم همه مرتبط با علم شیمی است. شاید بتوان گفت اگر علم شیمی را بگیریم مانند این است که در خلأ معلق هستیم. در واقع علم شیمی را نمی توان به عنوان یکی از علوم پایه از سایر علوم جدا و اظهار کنیم که این علم بیش از سایر علوم مهم تر است؛ زیرا امروزه همگرایی عجیبی بین علوم وجود دارد.
علم شیمی در چه حوزه هایی ملموس تر است؟
شیمی از یک سو با زیست شناسی، مواد فیزیک و زمین شناسی و از سوی دیگر با سایر حوزه های مختلف مانند پزشکی، دارو یا صنایع گوناگون همچون نفت، پتروشیمی، صنایع معدنی و شیمیایی ارتباط تنگاتنگی دارد، به همین دلیل در اغلب رشته های تحصیلی صنایع مختلف، گرایش علم شیمی وجود دارد. علاوه بر اینها می تواند در صنایع پزشکی و دارویی نیز کاربرد داشته باشد، به عنوان مثال امروزه از آلیاژها و ترکیبات شیمیایی در دندانپزشکی برای پر کردن دندان استفاده می شود.
علم شیمی به چند زیر شاخه تقسیم بندی می شود؟
در تقسیم بندی آکادمیک، علم شیمی به آلی، معدنی، تجزیه و شیمی فیزیک تقسیم بندی می شود؛ شیمی آلی به ترکیبات و مواد آلی، شیمی معدنی به ترکیبات معدنی و فلزات، شیمی تجزیه به آنالیز مواد و شیمی فیزیک هم به بررسی فرآیندهای شیمی و فیزیکی می پردازد. رشته هایی مانند شیمی نانو یا شیمی کاربردی هم جزو زیرشاخه های شیمی محسوب می شود.
شیمی محض و کاربردی چه تفاوت هایی با هم دارند. بیشتر دانشجویان علاقه مند به رشته محض هستند یا کاربردی؟
معمولا این تقسیم بندی در دوره کارشناسی مطرح است؛ در فوق لیسانس گرایش محض چهار شاخه شیمی آلی، معدنی، تجزیه و فیزیک و گرایش کاربردی هم میان دو رشته شیمی و مهندسی شیمی است. در سطوح کارشناسی شیمی محض، بیشتر به جنبه های تحقیقاتی و علمی قضیه یا ساینس می پردازد. شیمی کاربردی نیز ضمن بررسی جنبه های تحقیقاتی، مهندسی شیمی و حرکت کاربردی کردن دانش علم شیمی را پردازش می کند. به عنوان مثال برای این که یک کارخانه رنگ راه اندازی شود لازم است دانش و اطلاعات در رابطه با سنتز و تهیه مواد رنگی کاربردی و بررسی شود که آیا می تواند در مقیاس بیشتری تولید شود؟ چگونه می توان آن محصول را وارد بازار کرد؟ آیا پارامترهای صنعتی و تجاری این مساله می تواند دخیل باشد و کاربرد این علم را به جامعه یا صنعت داشته باشد؟
اما در مقاطع و سطوح بالاتر این تقسیم بندی (تفکیک) کمرنگ تر می شود. زیرا مرز شیمی محض و کاربردی بر یکدیگر نزدیک می شود.
یک دانشمند شیمی وقتی از خواب بر می خیزد تا زمانی که به خواب فرو می رود، چه کارهایی انجام می دهد؟
علم، ماهیتش به گونه است که اگر شما انگیزه و علاقه واقعی نداشته باشید، انجام آن کار شاید برای شما سخت باشد اما وقتی این انگیزه و علاقه وجود داشته باشد نه تنها انجام کارها سخت و دشوار نیست بلکه بسیار شیرین و لذتبخش هم است و مشتاق خواهید شد به دنبال آن کار بروید و سعی کنید از نظر علمی و کاربردی این کار را افزایش دهید و ایده تان را وارد جامعه کنید.
خیلی وقت ها این انگیزه زندگی معمولی ما شیمیدان ها را هم تحت تاثیر قرار می دهد. شاید یک کارمند عادی پس از سپری کردن ساعت کاری اش با خاطری آسوده به سایر کارهای زندگی اش رسیدگی کند؛ اما واقعیت این است که برای ما تعطیلی مفهومی ندارد. گاهی تا پاسی از شب هم ذهنمان درگیر کارهای علمی است. انجام دادن کارهای علمی نه تنها خسته کننده نیست بلکه گاهی به علت شیرینی و جذابیت این علم حتی متوجه گذشت زمان هم نمی شویم، حتی برخی اوقات هم وقت کم می آوریم.
علم شیمی از چه جذابیتی برخوردار است؟
یکی از مهم ترین جذابیت های علم شیمی این است که یک شیمیدان مدام با پدیده های جدیدی سروکار دارد و دائم فعالیت پژوهشی می کند که کارهای جدیدتری را انجام دهد.دومین جذابیتی هم که من سعی کرده ام آن را طی این چند سال دنبال کنم، انجام فعالیت های علمی و تعمیم کاربرد آن به بخش صنعت و جامعه است. صرفا فعالیت های علمی زمانی در جهان ارزشمند است که این فعالیت ها بتواند در جامعه هم کاربرد داشته باشد. وقتی ایده یک دانشمند شیمی در جامعه کاربرد پیدا می کند احساس لذتبخشی در او به وجود می آید که برای جامعه خودش مفید است و این احساس باعث ترغیب او برای انجام سایر فعالیت های پژوهشی می شود.
ساده ترین فرمول شیمیایی که در اطراف ماست، چیست؟
ساده ترین فرمول شیمیایی که همه به نوعی شاهد آن هستند اکسید شدن (مثلا زنگ زدن یک فلز بر اثر واکنش با اکسیژن) یا نمک طعام است؛ نمک از دو ترکیب ساده سود یا پتاس (Naoh) با اسید کلریک (Hcl) به وجود می آید. برای درست کردن یک ماده شیمیایی باید اندازه ترکیب ها دقت شود زیرا با مخلوط کردن چند ماده به ترکیب شیمیایی مورد نظرمان نمی رسیم. غذایی که ما می خوریم نیز یک واکنش زیستی، بیولوژی و شیمی است.
برخلاف این واکنش، فرآیند ترکیب نیز در سیستم بدن رخ می دهد مثلا هموگلوبین که یک ترکیب شیمیایی است وقتی خون اکسیژن را از ریه می گیرد به یک ترکیب شیمیایی جدید تبدیل می شود. این اکسیژن جذب شده بار دیگر در درون سلول ها تجزیه شده و اکسیژن را آزاد می کند.





 فصل 15 ( نوسان و موج ) کتاب علوم پایه هشتم
فصل 15 ( نوسان و موج ) کتاب علوم پایه هشتم  عدسی و توضیحات آن...
عدسی و توضیحات آن... آینهها (Mirorrs)
آینهها (Mirorrs)  سنگ شناسی رسوبی
سنگ شناسی رسوبی  سنگ شناسی دگرگونی
سنگ شناسی دگرگونی  سنگ شناسی آذرین
سنگ شناسی آذرین  معادن ایران
معادن ایران کانیهایی با نامهای ایرانی
کانیهایی با نامهای ایرانی کاربرد سنگ کنگلومرا
کاربرد سنگ کنگلومرا آیا میدانید که سنگ لوح چیست؟
آیا میدانید که سنگ لوح چیست؟ منظور از پوکی استخوان چیست ؟
منظور از پوکی استخوان چیست ؟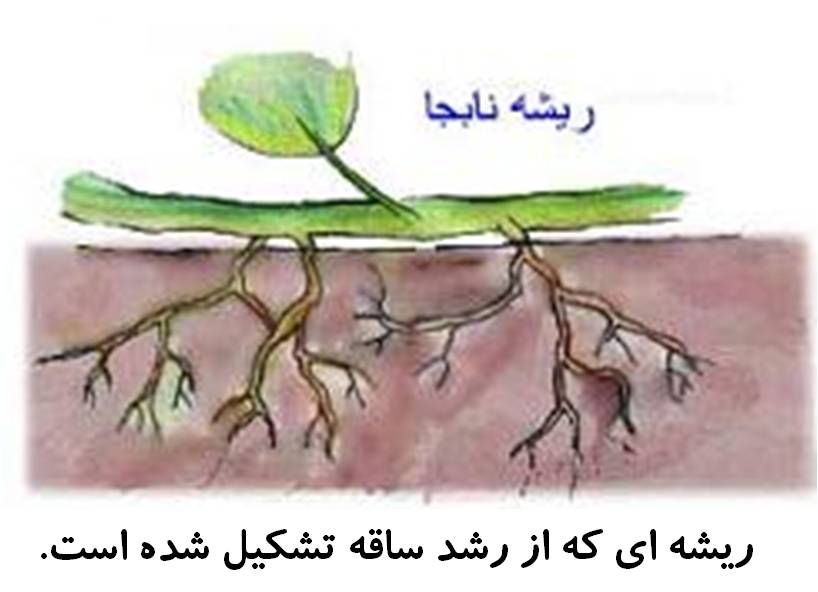 ریشه و انواع آن
ریشه و انواع آن راه های پیشگیری از زخم معده
راه های پیشگیری از زخم معده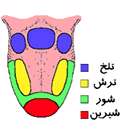 انواع مزه اصلی و جایگاه آن روی زبان
انواع مزه اصلی و جایگاه آن روی زبان مقاله ای کامل در مورد انرژِی بادی
مقاله ای کامل در مورد انرژِی بادی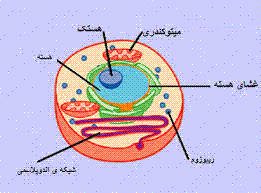 پروکاریوت ها و یو کاریوت ها چه هستند؟
پروکاریوت ها و یو کاریوت ها چه هستند؟ کات کبود
کات کبود فونوکاردیوگرام چیست؟
فونوکاردیوگرام چیست؟ حالت های درست و نادرست خوابیدن
حالت های درست و نادرست خوابیدن الماس
الماس گیج خوردگی و سرگیجه
گیج خوردگی و سرگیجه شیمی درمانی و پرتو درمانی سرطان چیست؟
شیمی درمانی و پرتو درمانی سرطان چیست؟ انیمیشن با موضوع فشار
انیمیشن با موضوع فشار کشف سیارهای با جوی مملو از آب!
کشف سیارهای با جوی مملو از آب! ایا64=65است؟؟
ایا64=65است؟؟ حیوانات در زمستان چطور گرم می شوند؟
حیوانات در زمستان چطور گرم می شوند؟